-
4
- 上一篇:含醇果汁饮料稳定性初探
- 下一篇:薏荞酥性饼干的工艺研究
1.3.4 氧化应激反应 5
1.3.5 细胞凋亡 5
1.3.6 自噬 6
1.3.7 转录后的基因调控 6
1.3.8 受体介导的细胞信号 8
1.4 研究的目的和意义 8
2 材料与方法 10
2.1 实验仪器 10
2.2 材料和试剂 11
2.2.1 表达载体 11
2.2.2克隆与表达菌株 11
2.2.3实验试剂、缓冲液、试剂盒 11
2.3实验方法 13
2.3.1表达载体构建 13
2.3.2目的蛋白的表达 14
2.3.3目的蛋白的纯化 14
2.3.4酶活测定 16
3 结果与分析 18
3.1表达载体的构建 18
3.2目的蛋白的表达和纯化 18
3.3目的蛋白的酶活测定 19
4 结论 21
致谢 22
参考文献 23
附录 26
1 绪论
1.1 甘油醛-3-磷酸脱氢酶的简介
甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase, GAPDH)参与糖酵解途径中的第六步反应,糖酵解反应示意图 如图 1.1,在细胞的碳代谢中起着核心作用,是维持生命活动能量形成的最基本酶之一。它普遍存在于众多生物体中,而且拥有高度种属保守序[1]。 GAPDH参与生物体内糖代谢反应是其最基本、最重要的生理特征,为维持不同物种的基本生命活动提供了能量源泉及辅助因子[2]。GAPDH几乎在所有组织中都高水平表达,且通常在同种组织或细胞中的表达量相对恒定,因此,常被用作研究其他基因和蛋白表达的内参照[3],它也被认为是一个经典的模式蛋白,常被用于蛋白质结构的分析和酶催化机理的研究中。在高等植物中有两种不同类型的GAPDH:一种存在于叶绿体中,是N ADP+依赖型;另一种存在于胞浆中,是依赖NAD+ 特异型,它由4个相同的亚基组成,每一个亚基均由 GapC 基因 (即依赖 NAD+的胞质型GAPDH基因) 编码,GapC是属于植物遭受逆境胁迫后高效表达的酶类。
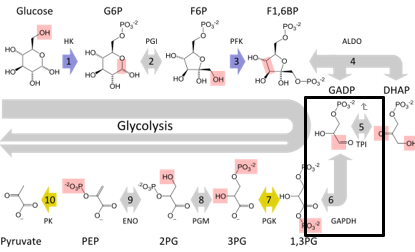
图 1.1 糖酵解的代谢途径
1.2 甘油醛-3-磷酸脱氢酶的结构特点
1987年来自于原核生物嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)的第一个GAPDH的结构被解析[4],随后来自于墨西哥利什曼原虫(Leishmania mexicana)、栖热水生菌(Thermus aquaticus)、大肠杆菌(Escherichia coli)的GAPDH的结构相继被解析出来[5-7]。GAPDH分子一般是由4个相同亚基组成的四聚体,其结构示意图 如图1.2.1。但不同种属的GAPDH亚基所含氨基酸残基数略有差异,从330到350个不等每一个亚基可以分为两个结构域:催化结构域和辅酶结合结构域。在糖酵解过程中,这两个结构域分别对应结合3-磷酸甘油醛和NAD+,从而催化3-磷酸甘油醛转变为1,3-二磷酸甘油酸,同时以NAD+为受氢体生成NADH,其结构示意图 如图1.2.2。GAPDH活性中心的Cys149处于折叠与螺旋的连结区,在已知三维结构的几个属的GAPDH中,活性中心附近部位的氨基酸序列完全相同,该区域结构稳定,说明不同种属的GAPDH中拥有高度保守序列在GAPDH分子中心与两个亚基的接触面存在S-loop区,其结构示意图 如图 1.2.3。该区域是一段二级结构含量较低的自由卷曲,它对整个分子结构的稳定性至关重要[8]。文献综述