- 上一篇:微波溶剂热法制备高性能LiMn1-xFexPO4及其电化学性能研究
- 下一篇:热处理工艺对Ni-Al复合轧制板材组织和性能的影响
电池工作原理示意图
SOFC具有以下优点:①功率大和载流密度大;②电池的正极与负极由于极化产生的消耗极小,而在电池的电解质的电阻上集中发生极化损失;③可直接使用可燃氢、工业甲醇、烃类燃料,不用贵金属做反应催化剂;④电池的存在状态为为全固体,所以不会产生液态的电解质腐蚀及装置封接问题;⑤可通过高温下废气的流通,来实现热能与电能的不断转换,所以它对燃料的利用率非常有效;⑥电解质的导电性能稳定良好,不受外界环境的影响,抗毒性好。所以,SOFC已被作为在未来可实现多生产且最有前景的新型发电技术,当今局势下,全球大国也在投入大量的人力物力开展和研究关于这一领域的工作[1]。在1000℃高温运行时,固体燃料电池出现了为很过问题,包括界面间发生电极反应、电极在工作过程中产生烧结、材料的热膨胀系数不相对应等。目前的研究方向是希望在降低燃料电池的操作温度条件下不改变SOFC性能的。在低温下工作时界面间的反应速率有所减小,并能选用更多的材料制备电池,从而对电池的结构设计的要求也在降低。将SOFC操作环境降至800℃时,由于在此环境下YSZ材料的到点效果偏低,必须大大降低降低YSZ材料制备薄膜的厚度(由100μm 左右降至10μm )或选用其他在低温条件下仍具有高导电效果的的电解质材料如Sc2O3 和稳定ZrO2 (ScSZ)、LaGaO3 等。
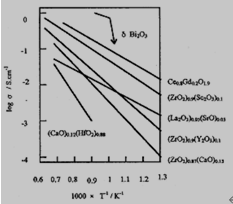
图1.2电解质电导率σ与温度T关系[3]
图1.3 ZrO2 基固体电解质掺杂组分与电导率σ关系[5] (800℃)
如果将SOFC的操作环境进一步下降到650~700℃,那么电池的制作材料可增加,例如,在板式SOFC中,可采用以前不能适用的价格便宜的耐热钢材料代替LaCrO3作为电池电极板的连接材料,并且不影响金属质材料高电导率、高导热性、易焊接、易成型等性能且这些优点都能得到充分的发挥;更重要的是,电池的工作环境在650℃左右时,甲烷能够在被直接氧化的情况下但不会出现积碳现象,因此对于在电池中安装的甲烷重整装置可以省去[6]。但是在此操作温度范围内,ZrO2基电解质不能够实现此应用要求。而是必须更换新型电解质材料如CeO2 基、Bi2O3基、LaGaO3 基等。图1.2、图1.3显示了当今人类新研制出的一些电解质材料的电导率性能。
1.2 固体氧化物燃料电池的发展
1839 年,W.G.Grove发表了第一篇有关于新型的发电形式燃料电池的研究报告。他的研究内容是将镀制Pt作为单电池的一个电极,以氢为燃料,氧为氧化剂,制备染料电池。在他的研究中指出,电池性能的提高主要在与电极的增强、气体和电解质之间的相互作用。1889 年,L.Mond和C.Langer研究了又一种新型中温固体氧化物燃料电池电解质材料,是一种浸有电解质的多孔非传导性材料,铂黑作为电池的电催化剂,燃料和氧化剂为氢和氧气。当运行时的电流密度达到3.5mA/cm 2时,电池的工作电压可以达到0.73V。在当时他们发明的电池结构已经现代的固体燃料电池非常相似了。1923 年,A.Schmid首次提出了电池可以采用多孔气体用以扩散电极的概念。在此基础上,双孔结构电极的理论又被F.T.Bacon提出。他的电极催化剂和自由电解质采用的廉价的金属,并成功的研制出了中温(200°C)培根型碱性燃料电池(AFC)。在此后20世纪60年代Pratt & Whitney公司成功研发出了一种新型的燃料电池作为Apollo登月飞船上的系统的主电源,此壮举为人类首次登月这一历史性的一刻做出了突出的贡献。进入50年代,聚四氟乙烯出现在应用领域里,美国的两家电气通用公司分别用它研制出了憎水电极。60年代初,美国电气通用公司研发出一种新型电池,它电解质隔膜的质子交换膜是通过离子交换膜完成的(PEMFC)。质子交换膜燃料电池,及时处于室温的环境中也能够被快速启动,并他的功能更加便捷,能够按照运行的负载要求调节输出功率,所以它成为了小型电动车和不用空气推动的核Y潜艇的动力来源,同时也成为了各种可移动电源的最佳替补者的行列。此后,各国又相继开发出了另一种新型的磷酸型燃料电池和熔融碳酸盐型燃料电池(分别以净化重整气和以净化煤气、天然气为燃料)。目前在全球各地已有近百台型号为 PC25的磷酸型燃料电池工作站(200kW)正在运行。在实践中得到证明他们的运行高度具有好的可靠性,并且可以在各种不间断电源与应急电源中广泛使用。固体氧化物燃料电池(Solid Oxide Fuel Cell)作为第四代燃料电池,不仅拥有燃料电池所具备的所有优点,还具备了有一些独特的特点:除此之外,它的电池工作站的厂房占地面积小,易建设,可进行部分式组装,高质量运行等优点。并且它的应用广泛,既可在集中型的大型电厂中使用,也可把它安装在环保型的电动汽车、轻巧型摩托上作为驱动电源。