- 上一篇:真空烧结Ti2AlC粉体及其结构分析
- 下一篇:氧化锆纤维板的成型工艺及对其性能影响研究
上世纪80年代,M.Armand等人提出了可以利用嵌锂化合物来代替金属锂负极,首次提出了“摇椅电池”的概念,即采用低嵌锂电势的LiyMmYn层间化合物代替金属负极,同时配以高嵌锂电势的化合物AZBW做正极材料,组成了不需要金属锂的二次锂电池。1987年,Auburn等人又提出MO2│LiPF6和PC│LiCoO2类锂离子电池的设计[3]。
在实现商业化锂离子电池体系中,目前的负极材料普遍使用性能稳定、价格低廉的石墨等碳素材料,因此改善正极材料的性能成为锂离子电池研究领域的关键部分。其中新型锂离子电池正极材料LiNi0.5Mn1.5O4的理论比容量为148mAhg-1,嵌锂电位高达4.7V,能量效率高,循环性能好,具有良好的发展前景。但是LiNi0.5Mn1.5O4正极材料尚存在循环性能不能令人满意、化学计量产物较难制备、产物中存在Mn3+等不足[4]。所以在本课题中主要利用化学掺杂(Ru、Ti及Ru/Ti共掺杂)来改善LiNi0.5Mn1.5O4的电化学性能。
1.2 锂离子电池的工作原理
锂离子电池本质上是一种浓差电池,它的正负极的活性物质都能够发生Li+嵌入-脱嵌反应。图1所示为锂离子电池的工作原理:
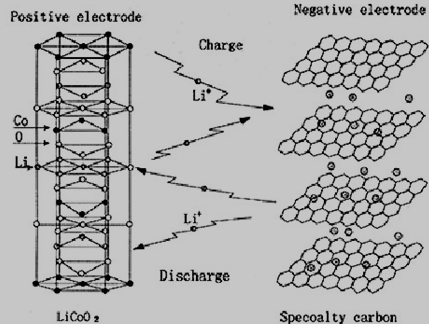
图1 锂离子电池的工作原理
充电时,Li+从正极活性物质中脱出,在外加电压的驱动下经由电解液向负极方向迁移,同时Li+嵌入负极物质晶格中;根据电荷平衡,则会有等电荷量的电子经过外电路从正极流向负极。充电的过程就是使电池达到正极贫锂态、负极富锂态的高能状态,此过程实现了电能向化学能的转化。放电过程中则相反,Li+从负极物质晶格中脱出,经过电解液向正极方向迁移,同时Li+嵌入正极化合物晶格中,外电路的电子流动则形成电流,此过程中化学能转换成电能。一般在正常的充放电情况下,Li+在层状的碳材料和层状结构氧化物的层间嵌入/脱嵌都不会破坏正极材料的晶体结构,因此从反应的可逆性来看,锂离子电池的充放电反应是一种理想的可逆反应[5]。
1.3 镍锰酸锂(LiNi0.5Mn1.5O4)作为锂离子电池的正极材料
正极材料是锂离子电池的一个重要组成部分,在锂离子电池的工作过程中,不仅要提供在正负极嵌锂化合物间嵌入与脱嵌所需要的锂,也要提供负极材料表面形成钝化膜(Solid Electrolyte Interface,SEI)所需要的锂。近年来,研究人员开发出正极材料有LiCoO2、LiFePO4、LiMn2O3、LiCoxNi1﹣xO2、LiMnO2、LiNi0.5Mn1.5O4、V2O5和LiNiO2等。一般说来,作为高能锂离子电池的正极材料应该满足以下几个要求:
1)Li+在嵌入化合物中应具有较高的氧化还原电势;
2)有充分多的离子通道,允许足够多的Li+可逆的嵌/脱,以保证电极过程的可逆性;
3)有足够多的位置接纳Li+,以使电池电极具有足够大的容量;
4)具有较高的离子电导率和电子电导率,以减小极化并提高充放电电流;
5)电子和离子的嵌入-脱嵌过程,对材料晶体结构的影响尽可能小,以保证锂离子电池性能的稳定;
6)在整个充放电电压范围内,具有较高的化学稳定性,不与或很少与电解质发生反应。
当然,在目前无论是成功实现商业化的或者正在开发的正极材料中,都没有完全符合上述条件的材料。其中,尖晶石型LiNi0.5Mn1.5O4具有较高的稳定输出电压(~4.7V),而且比LiCoO2、LiMn2O4和LiFePO4的能量密度高出15%~30%。另外,在三维尖晶石型结构中本征快Li+扩散能够引起较高的比容量,使得LiNi0.5Mn1.5O4在电动汽车上的应用具有很大的吸引力[6]。LiNi0.5Mn1.5O4的电化学性能对杂质、掺杂(取代)、结晶度及粒子尺寸分布和形态很敏感,因此要合成希望获得的的组成、结构和性能有很大的难度。现在已有大量的研究,如采用掺杂/取代[7-9]、涂覆[10]等不同的合成方法来改善LiNi0.5Mn1.5O4的电化学性能。来!自~751论-文|网www.751com.cn