-
液体有机电解质 Li/LE/TiS2
- 上一篇:纳米胶体的制备及其稳定性研究
- 下一篇:喷丸方法表面机械化处理纯金属的组织与性能研究
锂合金 过渡金属氧化物(V2O5,V6O13) 固体无机电解质 Li/SO2
液体正极(SO2)
Li的嵌入物
(LiWO2)
聚合物正极
聚合物电解质 Li/聚合物二次电池
Li/LE/LiCoO2
FS2正极 Li/LE/MoS2
硒化物(NbSc3) Li/LE/NbSc3
层状化合物 (LiCoO2, LiNiO2) Li/LE/LiCoO2
Li/LE/LiNiO2
Li 的碳化物
(LiCl2)
(焦炭) 增塑的聚合物电解质 Li/LE/V2O5
V6O13
尖晶石氧化锂(LixMn2O4) Li/LE/MnO2
1990 Li的碳化物(LiC6、石墨) 尖晶石氧化锰锂(LixMn2O4)
Li/LE/LiCoO2
Li/LE/LiMn2O4
1994 无定型碳
1995 氧化镍锂 凝胶电解质 凝胶锂电池
1997 锡氧化物
1998 新型合金
注:LE 为液体电解质;PE 为聚合物电解质
1.2 锂离子电池工作原理及特点
1.2.1 锂电池的工作原理
锂离子电池采用两种能够可逆地嵌入脱出锂离子的材料作为正极和负极, 并配以适当的电解液构成电池体系。电池充电时,Li+从正极化合物中脱出并嵌入负极晶格, 正极处于贫锂态;放电时则相反,Li+从负极脱出并嵌入正极,正极处于富锂态。从充放电反应的可逆性看,锂离子电池是一种理想的可逆反应电池。这种充、放电过程类似摇椅的往复运动,故锂离子电池又称摇椅电池[6](Rocking Chair Batteries,简称RCB)。锂离子电池的主要结构部分有正极、负极、能传导锂离子的电解质以及把正负极隔开的隔离膜。其基本结构与工作原理如图1.1:
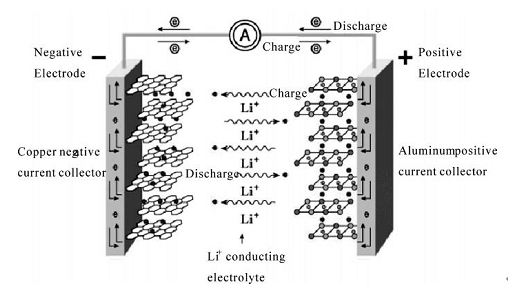
图1.1 锂离子电池工作原理示意图
1.2.2 锂离子电池的特点
锂电池具有以下的优点[7,8]:
1.工作电压高。锂离子电池的工作压约为 3.6 V ,而铅酸电池为2.0 V,Ni-Cd电池为1.2 V,Ni-H电池为1.26 V。由于有较高的输出电压,在使用电池时,避免了因为电池组带来的许多不便,也可以提高电池的使用效率。
2.比容量大。锂离子电池的体积容量和质量容量分别可达到360 W·h/cm和 160 W·h/kg。是镍氢电池的2倍,铅酸电池的4倍,锂离子电池的这一特点,大大降低了电池的体积,使得设备的便携程度大幅度提高。
3.自放电率小。锂离子电池可以在不使用的情况下,在自然储存的条件下,长时间的保存。由于锂离子二次电池在首次充电过程中,会在碳负极的表面形成一层固体电解质中间相(SEI)膜,这层膜允许离子通过但是不允许电子通过,因此可以较好地防止自放电,使得电池的自放电率大大减小。